发文机关国家药品监督管理局
发文日期2021年12月16日
时效性现行有效
发文字号国家药品监督管理局公告2021年第151号
施行日期2021年12月16日
效力级别部门规范性文件
为保障公众用药安全,根据《处方药与非处方药分类管理办法(试行)》(原国家药品监督管理局令第10号)的规定,经国家药品监督管理局组织论证和审定,将氢溴酸右美沙芬口服单方制剂由非处方药转换为处方药,按处方药管理。现将有关事项公告如下:
一、 相关品种(附件1)的药品上市许可持有人应依据《药品注册管理办法》等有关规定,于2022年3月24日前向国家药监局药品审评中心提出修订说明书的补充申请,其中安全性信息按照有关要求修订(附件2),说明书其它内容按照处方药要求进行修订,药品标签应当一并进行修订。
二、 本品修改说明书的补充申请批准后,相关品种的药品上市许可持有人应在9个月内对已出厂的药品说明书及标签予以更换,同时应及时收集并报告不良反应信息,做好风险控制及药物警戒工作。
相关品种的药品上市许可持有人、生产经营企业、临床使用单位,应严格按照处方药的相关管理要求生产、销售和使用本品。
三、 临床医师、药师在选择用药时,应当根据新修订说明书进行充分的获益/风险分析。患者应严格遵医嘱用药。
四、 各省级药监部门应当督促行政区域内的上述药品的药品上市许可持有人按要求做好相应说明书、标签的修订和更换工作,对违法违规行为依法严厉查处。
特此公告。
国家药监局
2021年12月16日
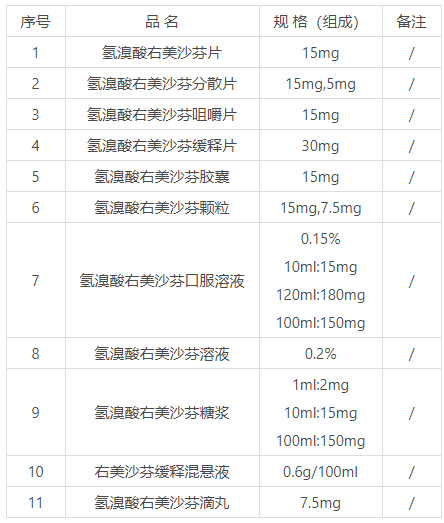
附件1.品种名单
附件2.说明书安全性信息修订要求
附件1
品种名单
附件2
说明书安全性信息修订要求
一、【不良反应】项应包含:
上市后监测发现使用氢溴酸右美沙芬口服单方制剂出现以下不良反应:
神经系统:嗜睡、头晕、头痛、眩晕、乏力、肌肉不自主收缩。
消化系统:恶心、呕吐、食欲缺乏、嗳气、口干、腹部不适(如胃痛)、便秘。
免疫系统:超敏反应和过敏反应,包括皮疹、荨麻疹、水肿、瘙痒和心肺功能障碍。
精神障碍:易激动、视幻觉、精神错乱,这些不良反应在服用过量药物的情况下更加明显。
皮肤和皮下组织:皮疹、荨麻疹、瘙痒症、红斑、过敏性皮炎。
二、【禁忌】项应包含:
1.对氢溴酸右美沙芬或本药的任何其他成份过敏者禁用。
2.妊娠3个月内妇女、哺乳期妇女禁用。
3.有精神病史者禁用。
4.正在服用利奈唑胺、单胺氧化酶抑制剂、5-羟色胺再摄取抑制剂(如氟西汀、帕罗西汀)、安非他酮等药物或服用这些药物停药不满两周的患者禁用。
三、【注意事项】项应包含:
1.用药7天,症状未缓解或病情加重,请咨询医师。
2.孕妇慎用。
3.肝肾功能不全患者慎用。
4.患有持续性或慢性咳嗽、严重肺部疾病及咳嗽变异性哮喘的患者慎用。
5.痰多的患者慎用。
6. CYP2D6基因多态性人群在服用本品之前应咨询医师。
7.正在服用镇静剂、身体衰弱或卧床不起的患者,在服用本品之前应咨询医师。
8.服药期间不得驾驶机车船、从事高空作业、机械作业及操作精密仪器。
9.本品不能与含酒精的饮品同时服用。
四、【相互作用】项应包含:
1.本品不得与单胺氧化酶抑制剂及抗抑郁药并用。正在服用或停止服用以下药物后的2周内,禁止服用本品,因会产生兴奋、高血压和高热(体温≥40℃)等不良反应:利奈唑胺、单胺氧化酶抑制剂(如吗氯贝胺、反苯环丙胺、氯硝柳胺、异丙嗪和异卡波肼)、选择性5-羟色胺再摄取抑制剂(如氟西汀、舍曲林或帕罗西汀)、安非他酮、丙卡巴肼、司来吉兰。
2.在开始服用本品之前,如果正在服用以下任何药物,应咨询医师,因为可能需要调整其中任何一种药物的剂量或停止治疗:胺碘酮、奎尼丁、非甾体类抗炎药(如塞来昔布、帕瑞考昔或伐地考昔)、中枢神经系统抑制剂(其中一些用于精神疾病、过敏、帕金森病等的治疗)、祛痰药和粘液溶解药、CYP2D6抑制剂(如氟哌啶醇)。
3.本品不宜与酒精及其他中枢神经系统抑制药物并用,因可增强对中枢的抑制作用。
五、【药物过量】项应包含:
过量服用右美沙芬可能产生以下症状:精神混乱、兴奋、紧张、烦躁、神志不清、支气管痉挛、呼吸抑制等,根据中毒的程度,这些症状可能会有所不同。
儿童过量服用右美沙芬可能产生以下症状:嗜睡、紧张、恶心、呕吐、步态改变等。
国外曾有报道,滥用含右美沙芬药物的青少年发生了严重的不良反应,如心动过速、嗜睡、高血压或低血压、瞳孔散大、躁动、眩晕、胃肠不适、幻觉、谵妄、眼球震颤、发热、呼吸急促、脑损伤、共济失调、癫痫发作、呼吸抑制、意识丧失、心律失常和死亡。在中毒的情况下应该采用对症治疗,其中包括静注纳洛酮和胃灌洗。
六、【药理作用】项
删除“长期服用无成瘾性和耐受性”相关表述。


